Ouvrez une bouteille de champagne, servez-vous une flûte, et observez attentivement le petit espace circonscrit par votre verre. Le champagne est un vin effervescent. Il se distingue bien évidemment des autres vins dits « tranquilles » par la formation de bulles une fois qu’il est servi dans un verre. Je vous invite à m’accompagner pour une dégustation de champagne que nous effectuerons sous l’angle de la science.
Profondément inscrite dans l’imaginaire collectif, la bulle de champagne devient prétexte à une flânerie scientifique qui nous entraîne dans le monde fascinant des gaz dissous, des changements de phase et des fluides en mouvement, depuis le débouchage d’une bouteille, jusqu’à l’éclatement d’une bulle.
Une bouteille sous forte pression
Suite à une seconde fermentation alcoolique en bouteille close, que l’on appelle la « prise de mousse », le champagne se charge en dioxyde de carbone dissous. Or, plus le vin est froid, et plus le gaz carbonique est soluble en son sein (on parle de solubilité du gaz carbonique), et la pression dans la bouteille sera donc aussi très sensible à la température.
La pression qui règne dans la bouteille augmente avec sa température. Elle varie de grosso modo 5 bars à 6 °C, à presque 8 bars à 20 °C. Or, puisque c’est la force exercée par le gaz carbonique sous pression dans le col de la bouteille qui est à l’origine de l’éjection du bouchon, la température de la bouteille doit donc de toute évidence jouer un rôle sur son débouchage.
Un nuage bleu au débouchage
Lorsque le bouchon saute, le volume de gaz carbonique sous pression dans le col de la bouteille se détend brutalement. Sa température chute alors de façon concomitante. Les physiciens parlent d’une détente adiabatique. De façon assez contre-intuitive, le gaz détendu se refroidit à une température d’autant plus basse que la température initiale de la bouteille (et donc sa pression) est élevée. Le débouchage d’une bouteille à température ambiante, sous une pression de l’ordre de 8 bars, a été filmé à l’aide d’une caméra rapide. On voit apparaître furtivement un nuage bleu profond qui s’évanouit environ 2 ms après le débouchage.
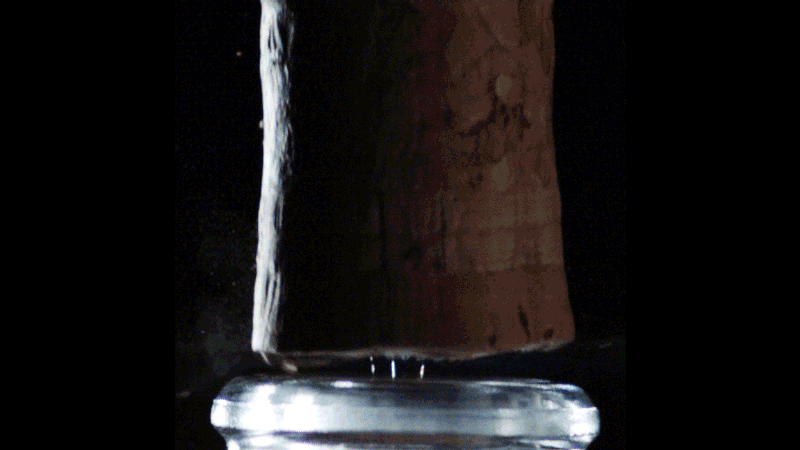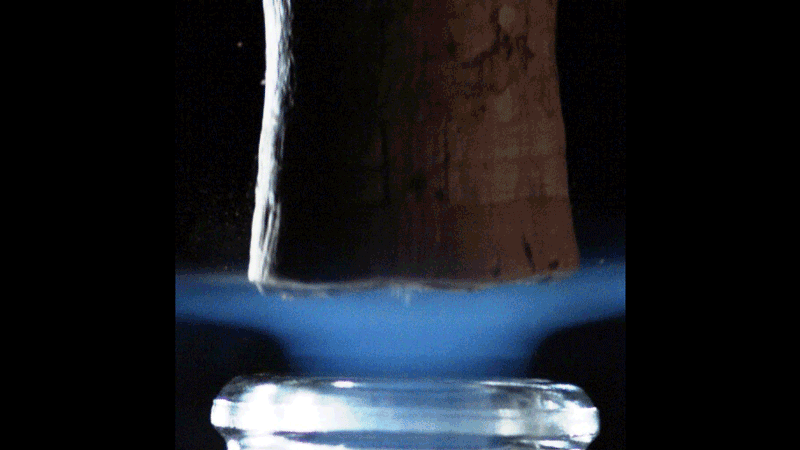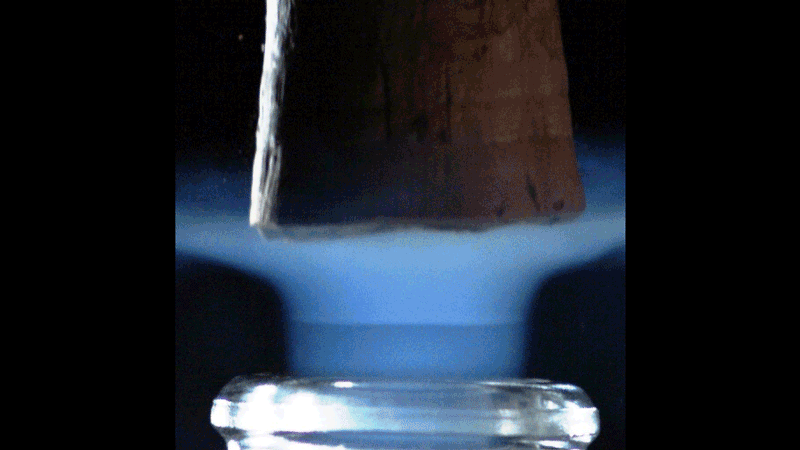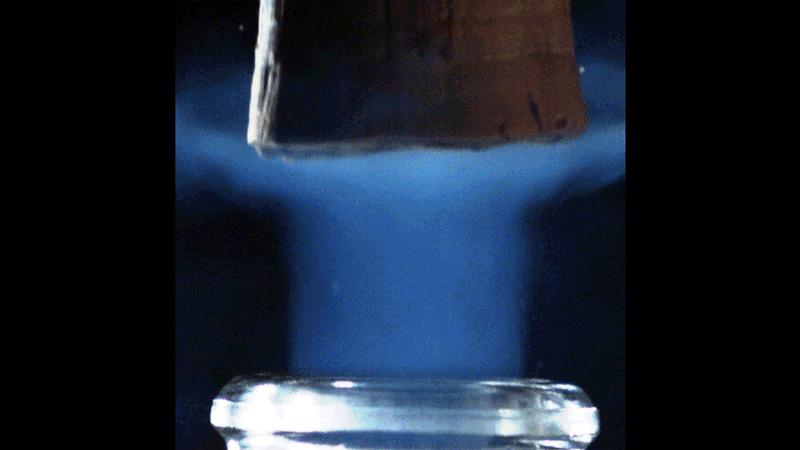
Sous un 1 bar de pression, le CO2 reste à l’état gazeux au-dessus d’une température de -78,5 °C. Mais en dessous de cette température, le CO2 existe sous sa forme solide (la glace carbonique). Pour une bouteille à 20 °C, la température des gaz qui se détendent chute à presque -90 °C. Les vapeurs de CO2 sont donc susceptibles de se transformer en glace carbonique, et le panache bleu azur serait donc la signature de la transformation des vapeurs de CO₂ en cristaux de neige carbonique. On distingue même une onde de choc très éphémère qui progresse dans ce nuage bleuté.
Ce phénomène est bien connu des ingénieurs de l’industrie spatiale et aéronautique. On retrouve en effet des ondes de choc dans le panache d’échappement supersonique soufflé par les tuyères des réacteurs d’un avion de chasse ou d’une fusée. Ces ondes de choc sont connues sous le nom de disques de Mach, du nom du physicien et philosophe autrichien Ernst Mach qui les décrivit pour la première fois.

Matthew Bruch/US Air Force
La nucléation des bulles dans une flûte
Une fois la bouteille débouchée, le champagne n’est plus sous pression. Le champagne contient dès lors beaucoup trop de CO2 dissous par rapport au nouvel équilibre imposé par la pression partielle très faible du gaz carbonique présent dans l’air ambiant. Le CO2 dissous doit inexorablement s’échapper du champagne pour rejoindre l’atmosphère. On dit que le champagne devient « sursaturé » en gaz carbonique.
Dans la grande majorité des cas, ce sont des fibres de cellulose provenant des torchons d’essuyage ou des aspérités du verre qui vont jouer le rôle de sites de nucléation de bulles une fois le champagne servi dans un verre. En effet, malgré leur complète immersion, ces fibres ou ces aspérités ne sont pas totalement mouillées par le liquide qui les enrobe et leurs propriétés physiques et géométriques permettent l’emprisonnement d’une minuscule poche d’air ambiant. Lorsque le champagne est servi dans une flûte, le CO2 dissous s’engouffre dans toutes les minuscules poches de gaz immergées afin de fuir le liquide pour lequel il n’a désormais plus aucune affinité.
Ces poches d’air immergées sont donc autant de minuscules germes par lesquels le CO2 dissous pourra fuir le champagne et rejoindre l’atmosphère sous forme de bulles. Du point de vue thermodynamique, le processus de nucléation de bulles à partir de minuscules fibres de cellulose accrochée à la surface d’une flûte de champagne est un phénomène identique à celui qui permet la nucléation de gouttes d’eau (par condensation de la vapeur d’eau atmosphérique) sur les minuscules grains de poussière ou de sel de mer se trouvant en suspension dans l’atmosphère, et qui jouent ainsi le rôle de sites de nucléation pour la formation des nuages.
L’ascension des bulles vers la surface
Une fois détachée de la particule qui lui a donné naissance, la bulle de champagne est encore invisible à l’œil nu. Sous l’effet de la poussée d’Archimède qui la tire vers le haut, la bulle entame alors son ascension vers la surface. Tout au long de son parcours, la bulle va se nourrir de gaz carbonique dissous dans le champagne. Elle va ainsi progressivement grossir et accélérer au cours de son ascension.
En plus de leur rôle esthétique évident, les bulles qui remontent dans le verre permettent de mettre en mouvement le champagne en drainant dans leur sillage un peu du champagne au sein duquel elle s’élève. Ce processus invisible à l’œil nu peut être mis en évidence par un procédé bien connu des physiciens des fluides : la tomographie laser. De fait, les mouvements de convection qui agitent le champagne renouvellent en permanence la surface du champagne en composés volatils odoriférants, permettant ainsi une perception des arômes plus efficace que celle qui serait ressentie lors de la dégustation d’un vin tranquille au repos.
Un aérosol chargé d’arômes
Au cours d’une dégustation de champagne, des centaines de milliers de bulles rejoignent la surface où elles éclatent, libérant ainsi le gaz carbonique et les arômes dont elles se sont chargées pendant leur ascension dans la flûte. Mais leur action ne s’arrête pas là. En éclatant, chaque bulle laisse une petite cavité à la surface du champagne qui, en se comblant, éjecte un mince filet de champagne susceptible de catapulter de minuscules gouttelettes plusieurs centimètres au-dessus de la surface du verre. Or, ces gouttelettes qui jaillissent à très grande vitesse s’évaporent aussi en partie, accélérant ainsi considérablement la libération des arômes du champagne. Nous avons récemment estimé que cet aérosol évapore jusqu’à dix fois plus efficacement les arômes d’un vin à bulles en comparaison de la simple évaporation des arômes qui se produit à la surface (sans l’action des bulles).
Changeons d’échelle et transportons-nous au-dessus de l’océan. À la surface des mers du globe, les vagues qui déferlent piègent de l’air dans l’eau sous forme de bulles. En remontant vers la surface puis en éclatant, ces bulles d’air diffusent un brouillard de gouttelettes. Ce sont les embruns océaniques. On estime à presque cent milliards de milliards (1020) le nombre de bulles qui éclatent ainsi chaque seconde à la surface des océans. Lors d’une campagne océanographique dans les océans Atlantique et Antarctique menée par mon collègue et ami le chimiste Philippe Schmitt-Kopplin sur le brise-glace allemand Polarstern, le transport vers l’atmosphère (sous forme d’embruns) de centaines de composés organiques dissous dans l’océan a été minutieusement décrit.
Le pétillement des océans constitue la plus grande source d’embruns et de composés organiques dissous impliqués dans la chimie complexe de l’atmosphère et donc dans l’équilibre climatique global. Les bulles océaniques qui éclatent « écrèment » la surface de l’océan, tout comme les bulles de champagne écrèment les molécules aromatiques de la surface du vin, les rendant ainsi accessibles à nos sens.
Gérard Liger-Belair, Université de Reims Champagne-Ardenne (URCA)
Image en tête : ©CIVC
Le lecteur désireux d’en apprendre plus sur l’univers du champagne et des vins effervescents pourra retrouver l’équipe Effervescence sur sa page Facebook ou se référer au livre Un monde de bulles. Le champagne ou la science de l’effervescence, écrit par l’auteur et paru chez Ellipses.
Gérard Liger-Belair, Professor, Université de Reims Champagne-Ardenne (URCA)
Cet article est republié à partir de The Conversation sous licence Creative Commons. Lire l’article original.


Très détaillé et intéressant !